(Ciencias de Joseleg) (Química) (Lenguaje químico) (Enlace químico) (Ejercicios resueltos) (Introducción) (Generalidades) (Historia) (Enlace químico fuerte) (Enlace químico débil) (Símbolos de Lewis y el octeto) (Energía reticular) (Enlace covalente y su representación) (Enlace covalente polar) (Diferenciando entre iónico y covalente) (Dibujado estructuras de Lewis) (Estados de oxidación, cargas formales y reales) (Resonancia) (Desviaciones del octeto) (Enlace covalente coordinado) (Enlace metálico) (Teoría del enlace de valencia) (Teoría del orbital molecular) (Efecto del enlace químico en los estados de la materia) (Referencias bibliográficas)
A principios de la década de 1900, Paul Drüde ideó la teoría del enlace
metálico del "mar de electrones" al modelar los metales como una
mezcla de núcleos atómicos (núcleos atómicos = núcleos positivos + capa interna
de electrones) y electrones de valencia. Los enlaces metálicos ocurren entre
los átomos de metales. Mientras que los enlaces iónicos unen metales con no
metales, y los covalentes a no-metales consigo mismos, los enlaces metálicos
unen la mayor parte de los átomos metálicos. Una hoja de papel de aluminio y un
alambre de cobre son lugares donde se puede ver la unión metálica en acción.
Los metales tienden a tener puntos de fusión y puntos de ebullición
altos, lo que no es compatible con el enlace covalente, lo que sugiere fuertes
enlaces entre los átomos. Incluso un metal blando como el sodio (punto de
fusión 97.8 °C) se funde a una temperatura considerablemente más alta que el
elemento (neón) que le precede en la tabla periódica. Cuando los átomos de
sodio se juntan, el electrón en el orbital atómico 3s de un átomo de sodio
comparte espacio con el electrón correspondiente en un átomo vecino para formar
un orbital molecular, de la misma manera que se forma un enlace covalente.
La diferencia, sin embargo, es que cada átomo de sodio está siendo
tocado por otros ocho átomos de sodio, y el intercambio ocurre entre el átomo
central y los orbitales 3s en todos los otros ocho átomos. Cada uno de estos
ocho está siendo tocado a su vez por ocho átomos de sodio, que a su vez son
tocados por ocho átomos, y así sucesivamente, hasta que haya absorbido todos
los átomos en ese trozo de sodio. Todos los orbitales 3s en todos los átomos se
superponen para dar una gran cantidad de orbitales moleculares que se extienden
por toda la pieza de metal. Tiene que haber una gran cantidad de orbitales
moleculares, por supuesto, porque cualquier orbital solo puede contener dos
electrones.
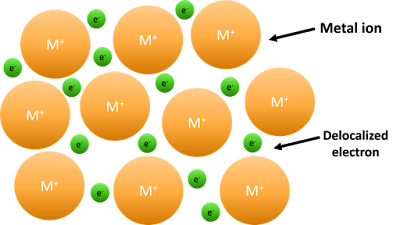
Los electrones pueden moverse libremente dentro de estos orbitales
moleculares metálicos, por lo que cada electrón se separa de su átomo original.
Se dice que los electrones están deslocalizados. El metal se mantiene unido por
las fuertes fuerzas de atracción entre los núcleos positivos y los electrones
deslocalizados.
Figura 16‑1. Enlace metálico: el modelo del mar de electrones: núcleos
atómicos positivos (círculos naranjas) rodeados por un mar de electrones
deslocalizados (círculos amarillos).
Esto a veces se
describe como "una matriz de iones positivos en un mar de
electrones". Si vas a usar esta analogía, ¡cuidado! ¿Un metal está formado
por átomos o iones? Está hecho de átomos. Cada centro positivo en el diagrama
representa todo el resto del átomo, excepto el electrón externo, pero ese
electrón no se ha perdido; puede que ya no tenga un vínculo con un átomo en
particular, pero todavía está allí en la estructura. Por lo tanto, el sodio
metálico se escribe como Na, no como Na+. Adicionalmente cuando un átomo de sodio pierde
un electrón éste es incapaz de mantenerse unido a la matriz metálica y por lo
tanto es expulsado inmediatamente, lo cual explica porque los procesos de
oxidación implica la pérdida de masa de un metal.
En un metal fundido,
el enlace metálico todavía está presente, aunque la estructura ordenada se haya
roto. El enlace metálico no se rompe por completo hasta que el metal hierve.
Eso significa que el punto de ebullición es en realidad una mejor guía para la
fuerza del enlace metálico que el punto de fusión. Al fundirse, la unión se
afloja, no se rompe. La fuerza de un enlace metálico depende de tres cosas:
👉 El número de electrones que se deslocalizan
del metal.
👉 La carga del catión (metal).
👉 El tamaño del catión.
Un enlace metálico
fuerte será el resultado de más electrones deslocalizados, lo que hace que aumente
la carga nuclear efectiva de los electrones en el catión, lo que hace que el
tamaño del catión sea más pequeño. Los enlaces metálicos son fuertes y
requieren una gran cantidad de energía para romperse y, por lo tanto, los
metales tienen puntos de fusión y ebullición altos. Una teoría del enlace
metálico debe explicar cómo puede ocurrir tanto enlace con tan pocos electrones
(ya que los metales están ubicados en el lado izquierdo de la tabla periódica y
no tienen muchos electrones en sus capas de valencia). La teoría también debe
tener en cuenta todas las propiedades químicas y físicas únicas de un metal.
Triángulo de van Arkel-Ketelaar
Anteriormente,
argumentamos que los enlaces entre átomos pueden clasificarse como un rango de
enlaces posibles entre enlaces iónicos (transferencia de carga total) y enlaces
covalentes (electrones compartidos por completo). Cuando dos átomos de
electronegatividades ligeramente diferentes se juntan para formar un enlace
covalente, un átomo atrae los electrones más que el otro; esto se llama enlace
covalente polar. Sin embargo, los enlaces "iónicos" y
"covalentes" simples son conceptos idealizados y la mayoría de los
enlaces existen en un continuo bidimensional descrito por el Triángulo de van
Arkel-Ketelaar.
Figura 16‑2. El triángulo de van Arkel-Ketelaar traza la diferencia en
electronegatividad ( Δχ ) y la electronegatividad promedio en un enlace ( ∑χ ).
La región superior es donde los enlaces son principalmente iónicos, la región
inferior izquierda es donde el enlace es metálico y la región inferior derecha
es donde el enlace es covalente.
Los triángulos de
enlace o triángulos de van Arkel-Ketelaar (llamados así por Anton Eduard van
Arkel y J. A. A. Ketelaar) son triángulos que se utilizan para mostrar
diferentes compuestos en diversos grados de enlace iónico, metálico y
covalente. En 1941, van Arkel reconoció tres materiales extremos y tipos de
unión asociados. Usando 36 elementos del grupo principal, como metales, metaloides
y no metales, colocó enlaces iónicos, metálicos y covalentes en las esquinas de
un triángulo equilátero, así como especies intermedias sugeridas. El triángulo
de enlace muestra que los enlaces químicos no son solo enlaces particulares de
un tipo específico. Más bien, los tipos de enlaces están interconectados y
diferentes compuestos tienen diferentes grados de diferente carácter de enlace
(por ejemplo, enlaces covalentes polares).
Propiedades metálicas
Los metales tienen
varias cualidades que son únicas, como la capacidad de conducir electricidad y
calor, una energía de ionización baja y una electronegatividad baja (por lo que
ceden electrones fácilmente para formar cationes). Sus propiedades físicas
incluyen una apariencia lustrosa (brillante), y son maleables y dúctiles. Los
metales tienen una estructura cristalina pero pueden deformarse fácilmente, es
decir, pueden doblarse. En este modelo, los electrones de valencia son libres,
deslocalizados, móviles y no están asociados con ningún átomo en particular.
Este modelo puede dar cuenta de:
Conductividad
Dado que los
electrones son libres, si los electrones de una fuente externa fueran empujados
hacia un extremo de un cable de metal, los electrones se moverían a través del
cable y saldrían por el otro extremo a la misma velocidad (la conductividad es el
movimiento de carga).
Maleabilidad y ductilidad:
El modelo del mar de
electrones de los metales no solo explica sus propiedades eléctricas, sino
también su maleabilidad y ductilidad. El mar de electrones que rodea a los
protones actúa como un colchón, por lo que cuando se martilla el metal, por
ejemplo, la composición general de la estructura del metal no se daña ni
cambia. Los protones pueden reorganizarse, pero el mar de electrones se
ajustará a la nueva formación de protones y mantendrá intacto el metal. Cuando
una capa de iones en un mar de electrones se mueve a lo largo de un espacio con
respecto a la capa debajo de ella, la estructura cristalina no se fractura,
sino que solo se deforma.
Capacidad calorífica:
Esto se explica por la
capacidad de los electrones libres para moverse por el sólido.
Brillo:
Los electrones libres
pueden absorber fotones en el "mar", por lo que los metales tienen un
aspecto opaco. Los electrones en la superficie pueden hacer rebotar la luz a la
misma frecuencia que la luz golpea la superficie, por lo tanto, el metal parece
estar brillante.
Sin embargo, estas
observaciones son solo cualitativas y no cuantitativas, por lo que no se pueden
probar. La teoría del "Mar de electrones" se presenta hoy solo como
un modelo simplificado de cómo funciona el enlace metálico.
Efecto de los electrones de valencia
en las propiedades metálicas
Se sabe que el punto
de fusión del magnesio (650 °C) es más alto que el del sodio (97,79 °C). El magnesio
tiene la estructura electrónica externa 3s2. Ambos electrones se
deslocalizan, por lo que el "mar" tiene el doble de densidad de
electrones que el sodio. Los "iones" restantes también tienen el
doble de carga (si va a usar esta vista particular del enlace metálico) y, por
lo tanto, habrá más atracción entre los "iones" y el "mar".
De manera más
realista, cada átomo de magnesio tiene 12 protones en el núcleo en comparación
con los 11 del sodio. En ambos casos, el núcleo está protegido de los electrones
deslocalizados por la misma cantidad de electrones internos: los 10 electrones
en los orbitales 1s2 2s2 2p6. Eso significa
que habrá una atracción neta del núcleo de magnesio de 2+, pero solo 1+ del
núcleo de sodio.
Así que no sólo habrá
un mayor número de electrones deslocalizados en el magnesio, sino que también
habrá una mayor atracción hacia ellos desde los núcleos de magnesio. Los átomos
de magnesio también tienen un radio ligeramente más pequeño que los átomos de
sodio, por lo que los electrones deslocalizados están más cerca de los núcleos.
Cada átomo de magnesio también tiene doce vecinos cercanos en lugar de los ocho
del sodio. Ambos factores aumentan aún más la fuerza del vínculo.
Los metales de
transición tienden a tener puntos de fusión y puntos de ebullición
particularmente altos. La razón es que pueden involucrar a los electrones 3d en
la deslocalización así como a los 4s. Cuantos más electrones pueda involucrar,
más fuertes tienden a ser las atracciones y más altos los puntos de fusión.


No hay comentarios:
Publicar un comentario