(Ciencias de Joseleg)(Química)(Lenguaje químico)(Reacciones
químicas)(Ejercicios
resueltos)(Introducción)(Cambios químicos y físicos)(Las reacciones químicas)(Historia)(Ecuaciones químicas)(Patrones de reactividad)(Reacciones redox)(Otros tipos de reacciones químicas)(Referencias bibliográficas)(Versión documento Word)
Para comunicarse
entre sí, los químicos han desarrollado un método estandarizado para
representar as reacciones químicas llamado, la ecuación química, la cual se
componen de fórmulas químicas y símbolos de condiciones de reacción, las cuales
en su conjunto deben resumir un proceso que ocurre en el mundo físico.
Una especie
química es una sustancia con un comportamiento fijo en sus reacciones. Es
decir, podemos tener cantidades diferentes obtenidas de lugares, modos y
momentos diferentes, pero al ser la misma especie/sustancia compartirán
exactamente sus mismas propiedades como el color, el sabor, la densidad, la
conductividad y la reactividad entre muchos otros. Una característica
primordial es que una especie es una sustancia que se encuentra en estado de
pureza cuyas propiedades se manifiestan de manera igual en cualquier porción
que se emplee para estudiarlas.
Muchas especies
diferentes poseen un comportamiento análogo, es decir, presentan un grupo de
reacciones similares frente a la acción de un buen número de reactivos. Estas
especies químicas se reúnen para su estudio y al analizarlas se ha determinado
que generalmente comparten un grupo de elementos enlazados de una manera
similar. A esta agrupación atómica común la denominamos grupo funcional. Independientemente
de si se trata de sustancias o grupos funcionales, el modelo que de ellos nos
hacemos en las ecuaciones químicas se basa en las fórmulas químicas que pueden ser
moleculares o estructurales, aunque también se pueden emplear símbolos
generales no relacionados con una sustancia en concreto, en este caso
generalmente se emplean mayúsculas. Toda
ecuación química intenta ser una representación de la balanza estequiométrica o
ley de la conservación de la materia.
La balanza
estequiométrica se representa de cuatro formas:
Se emplea el
símbolo de igualdad = únicamente para representar que la masa es constante a un
nivel netamente matemático.
La flecha simple
nos indica la dirección de una reacción química, la cual puede ser produce → que se emplea para reacciones en un solo sentido,
típicas de los procesos inorgánicos.
Las líneas dobles
⇆ empleadas para
representar reacciones reversibles que aún no alcanzan el equilibrio químico.
Las flechas ⇌ se emplean para reacciones reversibles
que han alcanzado un equilibrio químico.
El símbolo de
suma + sirve para indicar las especies químicas que deben mezclarse para
ejecutar la reacción y/o para representar las especies químicas de salida que
se desprenden de la reacción, que pueden estar mezcladas inicialmente y
separarse posteriormente por diferencias en sus propiedades físicas.
Otro tipo de
símbolos comunes son los de carga, que se dividen en virtuales y iónicos, los
virtuales (Fe+3) representan los estados de oxidación y se escriben
tenuemente o a lápiz sobre el símbolo del elemento, mientras que los iónicos
(Fe3+) se representan obligatoriamente como un superíndice en los
iones permanentes. La carga iónica en un grupo de átomos afecta globalmente al
grupo, por ejemplo, el ion sulfato (SO42-) tiene una
carga relativa z(SO42-)
= -2, pero a su vez cada elemento en el ion tiene su propia carga relativa
virtual que aporta a la carga neta del ion z(O)
= -2 y z(S) = +6
Coeficiente
estequiométrico o número estequiométrico
Para que la masa
se conserve, es común tener que emplear más de una molécula en los reactivos y
los productos, para representar más de una molécula por evento de reacción
debemos emplear símbolos de cantidad llamados coeficientes o números
estequiométricos (vi). Existen tres formas de representar los
coeficientes estequiométricos.
- Símbolo general
(vi), muy compun en textos
de fisicoquímica, pero prácticamente ausente en textos de química general.
- Mediante
símbolos algebraicos, en este caso se emplean minúsculas, y nuevamente, se
emplean para representar procesos generales aA + bB → cC + dD.
- Mediante
numerales arábigos O2 + 2H2 → 2H2O y es el método que empleamos para
igualar la cantidad de átomos a ambos lados del símbolo de la balanza
estequimétrica.
La ley de la conservación de la masa nos determina que la cantidad de átomos a un lado debe ser la misma al otro.
Los símbolos de
estado de materia también pueden ser importantes ya que están asociados a
estados energéticos, en este caso se emplean como subíndices al pie de las
fórmulas moleculares entre paréntesis, siendo estos: (s) sólidos cristalinos o
amorfos, (l) líquidos puros, (g) gases, (aq) mezclas en agua o acuoso y (p)
plasma.
La energía puede
ser representada de múltiples formas, una de las más comunes es la calórica. El
símbolo de energía calórica se representa con la letra griega delta mayúscula Δ,
la cual puede ubicarse como reactivo, como producto o como condición física
sobre la flecha.
En general la
Delta representa calor en forma de fuego, para otras formas de energía se
pueden emplear otros símbolos, siendo el más general (E). En las
ecuaciones 2, 3, y
4 se muestran diversos modos de representar el calor en una reacción
química, sea como producto, reactivo o condiciones. Si existen otros tipos de
energía o desea una notación más general puede reemplazar delta por
Cuando tenemos
sustancias en estados acuosos o líquidos que reacción para generar gases o
sólidos tenemos reacciones de evaporación o precipitación. Cuando el concepto
de la evaporación o la precipitación son importantes y se desea remarcarlo, se
emplean los símbolos de precipitación (↓) y
evaporación (↑) siempre después de la fórmula molecular.
Los catalizadores
son sustancias que intervienen en la reacción pero que no se consumen, se
colocan como condición de reacción sobre la flecha. Pueden ser elementos,
fórmulas moleculares con indicadores de pureza, o nombres de enzimas que pueden
ser solo las siglas.
5
6
7
Otras condiciones
físicas pueden aparecer en las fórmulas, como la electricidad simbolizada como e-, la luz, la presión y la
temperatura. La luz no tiene un símbolo estándar, así como la presión o la
temperatura por lo que se emplean sus valores numéricos con sus unidades
asociadas, por ejemplo la luz verde se asocia a rangos entre 495 y 570 nm; para
la presión normalmente se emplea la unidad atmósfera, por ejemplo la presión
estándar normal es de 1 atm al nivel del mar, aunque se pueden emplear otras
unidades; para la temperatura se pueden emplear las unidades °C o K, por
ejemplo la congelación del agua en condiciones estándar es a 0°C o 273,15 K.
En ocasiones,
especialmente en bioquímica, dos líneas de rutas de reacción pueden combinarse
en un paso denominado reacción acoplada, para volver a separarse. Estos pasos
de acoplamiento generalmente involucran una ruta principal que se simboliza
normalmente y una ruta acoplada que se simbólica con una flecha de produce
curvada.
8
La deshidrogenación
del etanol es una reacción clave en las rutas metabólicas relacionadas con las
bebidas alcohólicas.



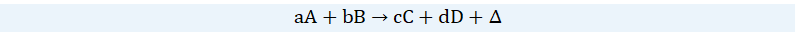






No hay comentarios:
Publicar un comentario