(Ciencias de Joseleg)(Química)(Lenguaje químico)(Formulación y nomenclatura inorgánica) (Ejercicios resueltos)(Introducción)(Historia)(Generalidades de la nomenclatura tradicional)(Generalidades de la nomenclatura Stock)(Generalidades de la nomenclatura sistemática)(Nomenclatura de isótopos)(Formulación química)(Fórmulas químicas teóricas)(Elementos)(Hidruros no metálicos)(Óxidos)(Hidróxidos)(Oxácidos)(Iones)(Sales)(Referencias bibliográficas)(Versión documento word)
Hasta ahora hemos visto a los elementos de forma
reduccionistas, como entidades aisladas del todo que no se unen, sin embargo,
en la naturaleza esto es cierto únicamente para los gases nobles, elementos que
existen como átomos aislados con mínimas interacciones con otros átomos. Sin
embargo, como se puede apreciar en la naturaleza, la materia interactúa para
formar sustancias. La formulación química es el modelo que intenta representar
las diferentes interacciones entre los diferentes átomos para formar moléculas
y sustancias, ya sean elementales o compuestas. Sin embargo, como todo modelo,
las fórmulas químicas tienen sus propias reglas.
Los nombres de los elementos y de las sustancias están
sometidos a las particularidades de cada idioma, pero las fórmulas no, ellas
están escritas a través de una serie de reglas que permiten su lectura por
cualquier individuo entrenado en cualquier parte del mundo. En consecuencia,
son las fórmulas quienes constituyen el verdadero lenguaje químico universal.
En química inorgánica la formulación por lo general está encerrada a un tipo de
fórmula, las fórmulas empíricas. De hecho, en su capítulo sobre formulación y
nomenclatura química Matamala y Gonzalez (1976) nos hablaban que: abundan
bachilleres con escasas nociones de formulación, y lo que es peor, que incurren
en falsedades y disparates ofensivos a la vista. Sencillamente no les fue
enseñado y más adelante fracasan en la resolución de problemas, por desconocer
las fórmulas correctas de los compuestos que intervienen.
Las fórmulas empíricas son útiles para describir algunas
propiedades de las fórmulas, pero no todas, es por esto que en este capítulo
introduciremos otros tipos de fórmula que nos ayudaran a la hora de dar nombre a
los compuestos y de tener mayor idea a la hora de abordar conceptos posteriores
de la química inorgánica como el balanceo y los procesos de
oxidación/reducción, aunque vale la pena aclarar que estas fórmulas no
necesariamente representan la verdadera naturaleza de los enlaces al interior
de una molécula. Podemos crear una hipótesis de fórmula que nos describe
correctamente la cantidad de átomos, pero puede que físicamente el tipo de
enlace que describimos y algunas propiedades eléctricas sean incorrectas. Eso
no significa que nuestro modelo esté mal, sino que no sirve para todas las
situaciones. Los modelos aquí descritos están enfocados a la nomenclatura
química.
Al igual que un modelo atómico es una forma de representar la realidad de un átomo, o que un mapa es la forma teórica de representar un lugar geográfico, durante el estudio de las moléculas emerge nuevamente la dualidad teoría/ fenómeno. Las fórmulas químicas son un mecanismo teórico, un modelo que intenta representar algunas de las propiedades de un fenómeno conocido como molécula química. Aunque en el lenguaje cotidiano del aula de química incluso los profesores solemos intercambiar ambas palabras como si se tratara de sinónimos, siempre debemos tener en cuenta que el fenómeno es por mucho, más complejo que la representación, generalmente bidimensional, que realizamos en el papel mediante las fórmulas.
Figura 11. Las fórmulas son el
mejor intento de describir a las moléculas, teniendo en cuenta los datos
experimentales y las necesidades del contexto de trabajo. En ocasiones el
contexto requiere de fórmulas poco precisas.
Esta tendencia a unificar la teoría con el fenómeno no es
exclusiva de la química, en la biología también sucede que no se hace
diferencia entre la teoría de la evolución que es un modelo teórico que intenta
representar algunas de las propiedades de los fenómenos evolutivos que son
mucho más complejos (Gould, 1981). Esta complejidad molecular
se lleva a su sentido más extremo en aquellas sustancias denominadas como “no
estequimétrica”. Las moléculas no estequimétrica no pueden ser representadas
por las leyes que empleamos normalmente durante la formulación química (Bevan & Hagenmuller, 2013), básicamente son sustancias
que violan la ley de las proporciones definidas de Proust. Pero no se traumen,
las sustancias no estequimétricas son sistemáticamente dejadas de lado por la
química escolar, aunque si hay que decir que muchas de ellas son empleadas por
los ingenieros como en superconductores de alta temperatura para crear
super-imanes (Bevan & Hagenmuller, 2013).
Tipos
de fórmulas
moleculares
Antes de formular hay que entender que existen diferentes
tipos de fórmulas, cada una con su propio reglamente, simbología y nivel de
precisión. No siempre necesitamos una estructura muy precisa para describir un
fenómeno. Las fórmulas moleculares se caracterizan por poder escribirse en
texto, en medio de un párrafo, siendo consideradas texto normal.
Las fórmulas empíricas son expresiones lineales en las que
se describe la cantidad relativa de átomos involucrados en la unión, aunque no
necesariamente es la cantidad de átomos en la molécula real, está referenciada
más al hecho de medir que al hecho de predecir. Sin embargo, a pesar de su
simplicidad, con las fórmulas empíricas podemos dar inicio a la descripción de
las propiedades generales que van a ir adquiriendo las demás fórmulas.
Específicamente los subíndices de cantidad (Connelly et al., 2005).
El subíndice de cantidad indica la cantidad de átomos, pero
afecta al elemento que se encuentra inmediatamente a la izquierda del elemento.
Para acostumbrar al lector a este hecho de los modelos de formulación química,
el subíndice será expresado con el código de color del elemento al cual afecta,
sin embargo, en los ejercicios a lápiz y papel donde todo está con un solo
color debe estar instintivamente memorizado este aspecto de las fórmulas
químicas.
Ejemplo 7:
Las fórmula empírica para la glucosa:
empírica
En la fórmula molecular tenemos, idealmente, una
representación de la cantidad absoluta de átomos presente en una molécula. Este
es el tipo de fórmulas que más analizaremos en este capítulo de química
inorgánica (Connelly et al., 2005). El problema fundamental es que, en muchas
moléculas simples, la fórmula empírica y la fórmula molecular son las mismas y
eso lleva a confusiones.
Ejemplo 8:
Las fórmulas molecular para la glucosa C6H12O6:
Formalmente denominados como compuestos de adición, estos se
forman por la unión de dos especies químicas aparentemente independientes,
donde una molécula actúa como centro y las demás como ligandos. La proporción
de ligandos se indica con numerales arábigos a la derecha de la molécula
(Connelly et al., 2005). Tenga en cuenta que los compuestos hidratados tienen
propiedades físicas y químicas diferentes de sus versiones no hidratadas,
además se las considera mezclas homogéneas en estado sólido.
Ejemplo 9: Carbonato de calcio hidratado NaCO3*H2O; ácido
sulfhídrico hidratado H2S*H2O.
La fórmula estructural condensada se asemeja a la fórmula
molecular en el sentido de que es una entidad lineal que podemos escribir al
interior de un texto. La fórmula estructural condensada intenta representar la
conectividad de los átomos sin dibujar los enlaces, y al mismo tiempo
representa la cantidad absoluta de átomos en la molécula. Este tipo de fórmulas
es más complejo y requiere conocer algunas reglas, como el tipo de sustancia
con el cual se está trabajando (Connelly et al., 2005).
Ejemplo 10:
Fórmula estructural condensada de la glucosa HCO(CHOH)5H.
Las
fórmulas estructurales buscan representar la conectividad y distribución de los
átomos al interior de la molécula, pero igual hay varios tipos. Estas fórmulas
no pueden hacer parte del texto y se consoderan figuras.
En química, el modelo bolas-y-palos es un modelo molecular de una sustancia química que sirve para mostrar tanto la posición tridimensional de los átomos y los enlaces entre ellos. Los átomos están típicamente representados por esferas daltonianas, conectadas por varillas que representan los enlaces.
Figura 12. Modelos de bolas y palos. Las fórmulas de bolas y palos
sirve ya sea en modelos abstractos o en modelos físicos de plástico para
representar la conectividad de las moléculas y su geometría molecular.
Los enlaces dobles
y triples suelen estar representados por dos o tres barras curvadas,
respectivamente, aunque esto no represente adecuadamente las entidades
matemáticas que predicen sus formas en el espacio llamadas orbitales. En un
buen modelo, los ángulos entre las varillas deben ser los mismos que los
ángulos entre los enlaces, y las distancias entre los centros de las esferas
deben ser proporcionales a las distancias entre los correspondientes núcleos
atómicos. El elemento químico de cada átomo se indica a menudo por el color de
la esfera.
En un modelo de
bolas-y-palos, el radio de las esferas es generalmente mucho menor que las
longitudes de varilla, con el fin de proporcionar una visión más clara de los
átomos y los enlaces a lo largo del modelo. Como consecuencia, el modelo no
proporciona una visión clara sobre el espacio ocupado por la molécula. En este
aspecto, los modelos de bolas-y-palos son distintos de los modelos de llenado
de espacio (Calotte), donde los radios de la esfera son proporcionales a los
radios atómicos en la misma escala que las distancias de los átomos y, por
tanto, muestran el espacio ocupado, pero no los enlaces. Los modelos de
bolas-y-palos pueden ser artefactos físicos o modelos de computadora virtual.
Los primeros se construyen generalmente a partir de kits de modelado molecular,
que consta de varios resortes helicoidales o varillas de plástico flexible, y
una serie de bolas de plástico con orificios preperforados. Los colores de la
esfera comúnmente siguen la coloración CPK. Algunos cursos universitarios sobre
química requieren que los estudiantes compren estos modelos como material de
aprendizaje.
En 1865, el
químico alemán August Wilhelm von Hofmann fue el primero en fabricar modelos
moleculares de bolas-y-palos. Él usó tales modelos en la conferencia
en la institución real de Gran Bretaña (Coleman,
2014; Zeinalipour-Yazdi, Pullman, & Catlow, 2016).
Figura 13. Modelos de punto y enlace. Los pares de electrones entre
átomos representan enlaces, y los pares de electrones libres los no enlazantes,
aquí aplicamos la ley del octeto, excepto para el hidrógeno.
Son diagramas que
muestran la unión entre los átomos de una molécula y los pares solitarios de
electrones que pueden existir en la molécula.
Se
puede dibujar una estructura de Lewis para cualquier molécula unida
covalentemente, así como para compuestos de coordinación. La estructura de
Lewis fue nombrada después de Gilbert N. Lewis, que lo introdujo en su artículo
de 1916 el átomo y la molécula. Las
estructuras de Lewis pueden ser dos tipos, las mas comunes son las de punto-enlace
“imagen anterior” que representan a todos los electrones como puntos, pero
también pueden ser de enlace y electrón donde los electrones compartidos que
forman enlaces se representan como vínculos o líneas, cada línea representa dos
electrones enlazantes.
Las
estructuras de Lewis muestran cada átomo y su posición en la estructura de la
molécula usando su símbolo químico. Las líneas se dibujan entre átomos que
están unidos entre sí (se pueden usar pares de puntos en lugar de líneas). El
exceso de electrones que forman pares solitarios se representan como pares de
puntos y se colocan junto a los átomos. Aunque los elementos del grupo
principal del segundo período y más allá reaccionan generalmente ganando,
perdiendo o compartiendo electrones hasta que han logrado una configuración de
electrón de la cáscara de valencia con un octeto completo de electrones, otros
elementos obedecen reglas diferentes. El hidrógeno (H) sólo puede formar
enlaces que compartan sólo dos electrones, mientras que los metales de
transición a menudo se ajustan a un duodecteto.
En las fórmulas de
líneas se representa cada pareja de electrones enlazantes covalentes como una
línea, pero los enlaces iónicos se siguen representado con una expresión de
punto-enlace o simplemente representando las cargas del dipolo iónico. En
resumen, solo presentamos como líneas los enlaces covalentes y covalentes
polares. En ocasiones los electrones no enlazantes también se presentan como
puntos. Básicamente es una estructura de enlace de Lewis sin los electrones desapareados.
Se denomina completa debido a que se representan todos los átomos en l
molécula, lo cual para las moléculas orgánicas resulta un poco molesto, debido
a la gran cantidad de hidrógenos que hay.
Figura 14. Modelo de barra y enlace. Por mucho son lo más común que
vamos a tener en este capítulo introductorio, cada enlace representa a dos
electrones compartidos.
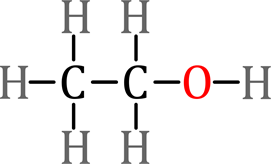
La fórmula esquelética, también llamada fórmula lineal o fórmula taquigráfica, de un compuesto orgánico es un tipo de fórmula estructural molecular que sirve como representación abreviada de la unión de una molécula y algunos detalles de su geometría molecular.
Figura 15. Modelo de esqueleto. Los carbonos e hidrógenos unidos
a estos están implícitos en puntas y vértices, para enfocarnos únicamente en
los grupos funcionales.
Una fórmula
esquelética muestra la base de una molécula, que se compone de los átomos de
carbono que forman la molécula. Se representa en dos dimensiones, como en una
página de papel. Emplea ciertas convenciones para representar átomos de carbono
e hidrógeno, que son los más comunes en química orgánica, así como la
tridimensionalidad si es necesario.
La técnica fue desarrollada
por el químico orgánico Friedrich August Kekulé von Stradonitz. Las fórmulas
esqueléticas se han vuelto omnipresentes en la química orgánica, en parte
porque son relativamente rápidas y fáciles de dibujar. Pueden considerarse
estructuras de Lewis abreviadas observando las siguientes convenciones:
∎un átomo de carbono se indica como el término de un
segmento de línea o el punto de encuentro de segmentos de línea;
∎los átomos de hidrógeno conectados a los átomos de
carbono no se muestran, sino que están implícitos, de modo que cada átomo de
carbono está unido al número de átomos de hidrógeno que satisfaría la regla del
octeto “en términos practicos es satisfacer el poder de enlace de cada átomo,
por ejemplo, para el carbono es 4, para el nitrógeno es 3 o para el oxígeno 2”,
o de otra manera mantener la consistencia con la carga formal y el número de
Electrones no enlazantes en el carbono;
∎heteroátomos y átomos de hidrógeno unidos a ellos se
muestran como un solo grupo (por ejemplo, OH, NH 2) sin mostrar explícitamente
los enlaces heteroátomo - hidrógeno;
∎se muestran opcionalmente pares de electrones no
unidos en heteroátomos. Como en una estructura de Lewis, un segmento de línea
doble o triple indica unión doble o triple, respectivamente.
Aunque las
proyecciones de Haworth y las proyecciones de Fischer parecen algo similares a
las fórmulas esqueléticas, existen diferencias en las convenciones utilizadas,
que el lector necesita conocer para comprender los detalles de una molécula.
Adicionalmente, las fórmulas de esuqleto serán las formulas estructurales
preferidas a todo lo largo de la química orgánica, así que la describiremos con
mayor profundidad en el siguiente capítulo.
Una proyección
de Haworth es una forma común de escribir una fórmula estructural para
representar la estructura cíclica de los monosacáridos con una perspectiva
tridimensional simple. La química orgánica y especialmente la bioquímica son
las áreas de la química que más utilizan las proyecciones de Haworth.
Figura 16. Proyección de Haworth para la
glucosa. Se usa para modelar azúcares cíclcicos.
La proyección de Haworth fue
nombrada en honor del químico inglés Sir Norman Haworth. Una proyección de
Haworth tiene las siguientes características:
∎El carbono es el tipo implícito de átomo. En el
ejemplo anterior los átomos numerados de 1 a 6 son todos átomos de carbono. El carbono
1 se conoce como carbono anomérico;
∎Los átomos de hidrógeno en el carbono están
implícitos. En el ejemplo, los átomos 1 a 6 tienen átomos de hidrógeno
adicionales no representados;
∎Una línea más gruesa indica los átomos que están más
cerca del observador. Los átomos 2 y 3 (y sus correspondientes grupos OH) son
los más cercanos al observador. Los átomos 1 y 4 están más alejados del
observador. El átomo 5 y los otros átomos son los más lejanos;
∎Los grupos por debajo del plano del anillo en las proyecciones
de Haworth corresponden a los del lado derecho de una proyección de Fischer.
Esta regla no se aplica a los grupos en los dos carbonos del anillo unidos al
átomo de oxígeno endocíclico.
La proyección
de Fischer, ideada por Hermann Emil Fischer en 1891, es una representación
bidimensional de una molécula orgánica tridimensional por proyección. Las
proyecciones de Fischer fueron propuestas originalmente para la representación
de carbohidratos y usadas por los químicos, particularmente en química orgánica
y bioquímica. El uso de proyecciones de Fischer en no carbohidratos no es
aconsejable, ya que tales dibujos son ambiguos cuando se confunden con otros
tipos de moléculas.
La teoría estructural les permitió a los primeros químicos
orgánicos comenzar a resolver varios problemas fundamentales que los acosaban.
En especial el problema del isomerismo. Estos químicos frecuentemente se
encontraban con ejemplo de diferentes sustancias que tenían las mismas formulas
moleculares pero que presentaban propiedades físicas y/o químicas diferentes. A
estas sustancias se las denominó isómeros. Consideremos un ejemplo. Tenemos dos
compuestos con la formula molecular C2H6O que son
claramente diferentes debido a sus diferentes propiedades.
Observe que estos dos isómeros poseen puntos de ebullición y
por eso uno es un gas a temperatura ambiente y el otro es un líquido. Debido a
que la fórmula molecular de ambos compuestos es la misma, esta no nos sirve
para entender las diferencias entre las propiedades físicas de ambas
sustancias. La teoría estructural remedia esta situación al adjudicarle a cada
sustancia una fórmula estructural diferente, con diferentes tipos de conexiones
entre los átomos.
Posteriormente en 1874 las formulas estructurales originadas
por kekulé, Couper y Butlerov fueron expandidas a las tres dimensiones por
medio de trabajos independientes de JD van´t Hoff y JA Le Bel. Ambos
propusieron que los hidrógenos en la molécula del metano (CH4) se
encontraban dispuestos como si estuvieran apuntando a las puntas de un polímero
regular llamado tetraedro. Hasta entonces a la molécula de metano se la
dibujaba plana como si fuera una cruz. El conocimiento de la disposición en
tres dimensiones de las moléculas es vital para el entendimiento de la química
orgánica y cualquier otra ciencia que dependa de ella como la bioquímica.






No hay comentarios:
Publicar un comentario